治験・製造販売後臨床試験
症例ファイル作成
原則スタートアップミーティング時までに、症例ファイルの作成をお願します。
作成後、1部お送りください。CRCが内容確認後、返送いたします。
スタートアップミーティング時に、訂正した症例ファイルを症例数分(多い場合は数部)ご用意ください。
作成後、1部お送りください。CRCが内容確認後、返送いたします。
スタートアップミーティング時に、訂正した症例ファイルを症例数分(多い場合は数部)ご用意ください。
治験実施ファイル(症例ごと)の作成要領
<治験開始後に内容の変更が生じた場合、直ちに差し替えてください。>
注意:ファイルは厚すぎたり、薄すぎたりしないよう適切な厚さのファイルをご使用ください。
注)被験者識別コードについて依頼者で取り決めが無い場合、本院の識別コードを振りますので、その記載をお願いします。
(H○○-○○(契約番号)-00●(1~)
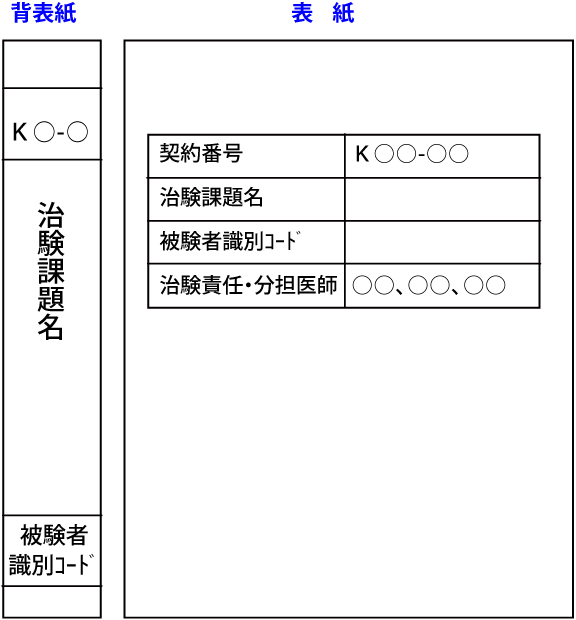
| 背表紙: | 治験題名、契約番号、被験者識別コード 等 |
|---|---|
| 表 紙: | 契約番号、治験題名、被験者識別コード、治験責任・分担医師名 |
(H○○-○○(契約番号)-00●(1~)
以下、ポケットファイルを用い、ファイルには項目毎・Visit毎に見出し(インデックス)をつけてください。
| 項目 | 内容、注意・依頼事項 |
|---|---|
| 【モニターの連絡先】 |
緊急時・休日など必ず連絡が取れるよう複数件の連絡先を記載してください。
|
| 【スケジュール表】 | 患者用、Dr./CRC用 ※ 予定日、来院日が記載できるもの。検査・調査の許容範囲を記載してください。 治験概略のポケット版があれば入れてください。 |
| 【併用禁止薬】 | 製品名でソートした一覧 表紙:併用禁止薬の規定(プロトコール上の表現) 内容:一般名、製品名、剤型、プロトコル上の規定内容 同種同効薬・併用制限薬も同様に作成してください。
|
| 【同種同効薬】 | |
| 【併用制限薬】 | 併用制限がある場合、その内容と薬剤の種類等の一覧 同意、登録、投与前より使用を禁止する薬剤があれば、使用禁止期間等が分かるような図・表等もご提供ください。
|
| 【選択基準・除外基準】 | |
| 【同意説明文書】 | 同意説明文書、患者向けの「補償制度の説明資料」、治験参加カード
備1~2部を用意してください。
|
| 【被験者識別コードの 割振り方】 |
依頼者で取り決めがない場合は、その旨を記載してください。 |
| 【治験薬の オーダリング方法】 |
*空ポケット*
オーダリング方法を示した書類を当院で準備します。
|
| 【医事課費用連絡用紙】 |
契約番号、診療科、治験薬、依頼者名等、記載可能な事項を記載してください。
|
| 【覚書】 | 覚書の写し(費用に関するもののみ) |
| 【患者さんから 回収するもの一覧】 |
未使用薬、空シート、治験薬小箱などがある場合その内容ない場合はその旨、記載してください。 |
| 【治験薬管理手順書】 | |
| 【連絡状】 |
併用禁止薬、併用制限薬、注意事項や、治験を実施している医師の連絡先を記入できるようにしてください。
|
| Visitページ | 1Visit 1見開きにしてください。 |
| 左側ポケット | チェックシート(経時的にまとめたもの)
できるだけチェックシートは1枚にまとめてください。
外注検査の検査処理手順について、検査キット毎に同封されない場合、処理手順書を該当Visitのポケットに入れてください。
登録等の手続きが必要な場合、手順を用意してください。
|
| 右側ポケット | ワークシート、調査用シート、アンケート用紙等必要なVisit毎に準備してください。 |
| Visitページ終了後、以下の資料を入れてください。 | |
| プロトコル | 別紙資料、特殊な機器の手順等を含む |
| 評価項目の基準 | 評価項目の基準などがある場合はその基準 |
| 症例報告書の手引き | EDCの場合は入力手順 |
| 重篤な有害事象報告 | 報告方法、連絡先、書式 |
| スクリーニング名簿 | 2部入れてください。
症例ファイルが複数ある場合はどれか1冊にいれてください。
|
症例ファイルの以下の資料については、担当CRC宛に電子媒体も合わせてご提供ください。
電子媒体で提供が出来ない場合はその旨ご連絡ください。
電子媒体で提供が出来ない場合はその旨ご連絡ください。
- スケジュール表:規定日、許容範囲が自動計算されるもの
- 併用禁止薬、同種同効薬、併用制限薬の一覧:一般名、製品名でソートできるもの
- 医事課費用連絡用紙
- 連絡状(見本あり)
- 重篤な有害事象報告書
- 各種マニュアル
- 検体回収依頼用紙
- プロトコル
- 治験薬管理手順書
- ワークシート

